Строение бледной трепонемы. Антигенный состав бледной трепонемы
Возбудитель сифилиса — бледная трепонема
Возбудителем сифилиса является бактерия спиралевидной формы (т.наз. спирохета) — бледная трепонема . Латинское название - Treponema pallidum подвид pallidum.
Она была открыта в 1905 году Шаудином и Хоффманом (F. Schaudinn и Е. Hoffman) и получила свое название из-за слабой способности воспринимать окраску лабораторными красителями. В активном патогенном состоянии она имеет диаметр 0,2-0,4 мкм и длину от 6 до 14 мкм. В организме человека размножается поперечным делением через каждые 30-33 часа.
Существуют и другие патогенные трепонемы:
Treponema pallidum подвид pertenue - возбудитель фрамбезии,
Treponema pallidum подвид endemicum - возбудитель беджеля,
Treponema carateum - возбудитель пинты
Treponema pallidum подвид endemicum - возбудитель беджеля,
Treponema carateum - возбудитель пинты
Указанные возбудители и вызываемые ими болезни (трепонематозы) встречаются в регионах с жарким и влажным климатом. Это страны Африки, Азии, Латинской Америки и Тихоокеанского региона, расположенные в зонах тропических лесов.
Бледная трепонема является облигатным паразитом — микроорганизмом, живущим исключительно за счет организма хозяина и неспособным выживать и размножаться вне его.
Традиционно считалось, что, эта бактерия является строгим анаэробом, то есть может существовать только при отсутствии в среде обитания молекулярного кислорода (т.е. в анаэробных условиях). Но к настоящему времени выяснилось, что бледная трепонема относится к микроаэрофилам и растет в условиях пониженных концентраций кислорода (по сравнению с содержанием кислорода в обычном воздухе).
Несмотря на активные попытки исследователей вырастить эти бактерии вне живых организмов («in vitro»), трепонема не культивируется на простых питательных средах. Те культуральные трепонемы, которые удается вырастить комплексными методами на питательных средах, утрачивают свою вирулентность (патогенность), но частично сохраняют антигенные свойства. Разработаны сложные среды, в которых болезнетворные трепонемы не размножаются, но сохраняют свою жизнеспособность в течение 18-21 дней. Возбудители других трепонематозов также не удается вырастить in vitro.
Обычно T. pallidum культивируется путём заражения кроликов. Проявления сифилиса, наиболее сопоставимые у людей и у кроликов с экспериментальным сифилисом, получают при заражении кроликов в яичко патогенными бледными трепонемами (сифилитический орхит). Для этого используют лабораторный штамм Никольса (Nichols), специально адаптированный для животных.
Штамм Никольс был выделен в 1912 году из спинномозговой жидкости пациента с ранним нейросифилисом (работа американских ученых Nichols and Hough, 1913). Этот штамм стал эталонным в лабораторных исследованиях сифилиса и уже более столетия пассируется (перевивается) на кроликах. Штамм Никольс остается заразным и для человека; несмотря на многолетнее культивирование на кроликах, известны случаи случайного лабораторного заражения работников лабораторий.
Технология получения новых лабораторных штаммов из клинических изолятов, выделенных непосредственно от больных сифилисом, трудоемка и занимает длительное время. Это связано, в частности, с тем, что до настоящего времени не разработано эффективной технологии поддержания жизнедеятельности патогенных бледных трепонем в лабораторных условиях.
Трепонема способна размножаться в узком температурном диапазоне — около 37 °C.
В окружающей среде бледная трепонема слабоустойчива, при 55 °С гибнет в течение 15 мин, чувствительна к высыханию, свету, солям ртути, висмуту, мышьяку, пенициллину. При 60°С она гибнет через 10-15 минут, а при кипячении (при 100°С) гибнет мгновенно. При комнатной температуре во влажной среде трепонемы сохраняют подвижность до 12 часов. Кроме того, возбудитель сифилиса довольно чувствителен к большинству антисептических средств. К низким температурам бледные трепонемы устойчивы.
Грамотрицательные бактерии — бактерии, которые не окрашиваются кристаллическим фиолетовым при окрашивании по Граму. В отличие от грамположительных бактерий, которые сохранят фиолетовую окраску даже после промывания обесцвечивающим растворителем (спирт), грамотрицательные полностью обесцвечиваются. Бледная трепонема является грам-отрицательной бактерией.
Строение бледной трепонемы
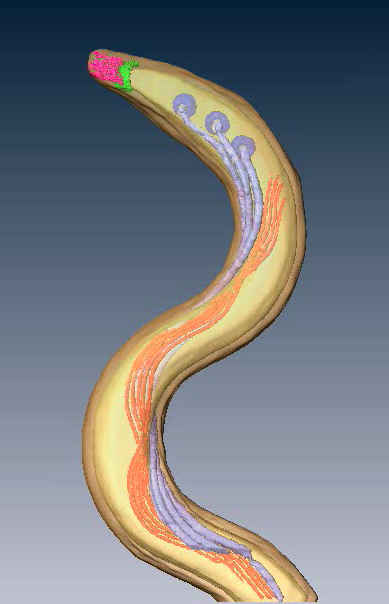 Трехмерная рендер-модель бактерии T. pallidum. Изображены внешняя и цитоплазматическая мембрана (прозрачный желтый), базальные тела (темно-лиловый), аксиальные фибриллы (светло-лиловый), цитоплазматические нити (оранжевый), серповидная "шапочка" возле закругленного конца цитоплазматической мембраны (зеленый), и коническая структура на полюсе (розовый). Пептидогликановый слой не отображен на рендер-модели.
Трехмерная рендер-модель бактерии T. pallidum. Изображены внешняя и цитоплазматическая мембрана (прозрачный желтый), базальные тела (темно-лиловый), аксиальные фибриллы (светло-лиловый), цитоплазматические нити (оранжевый), серповидная "шапочка" возле закругленного конца цитоплазматической мембраны (зеленый), и коническая структура на полюсе (розовый). Пептидогликановый слой не отображен на рендер-модели.Строение бледной трепонемы (T. pallidum подв. pallidum) было изучено более подробно и изучается в настоящий момент параллельно с развитием иммунологии и электронной микроскопии, начиная с 70-80 годов XX века.
Строение T. pallidum во многом похоже на строение других спирохет.
Проведенные с помощью электронной микроскопии исследования морфологии бледной трепонемы показали, что центральной структурой клетки Т. pallidum является спирально извитой протоплазматический цилиндр.
Протоплазматический цилиндр снаружи окружен цитоплазматической мембраной и плотно прилегающей к нему тонкой клеточной стенкой, основу которой составляет пептидогликан.
Кроме этого, бледная трепонема имеет осевые фибриллы, которые плотно обвиваются вокруг протоплазматического цилиндра. Полагают, что именно они обеспечивают подвижность трепонем, хотя полная функциональность фибрилл не описана в достаточной степени.
Пептидогликан, также известный как муреин, является сложным полимером. Он поддерживает структурную целостность цитоплазматической мембраны и стабилизирует фибриллярный двигательный комплекс. Этот полимер достаточно эластичный, чтобы не мешать сгибательным движениям трепонем.
Бактерия имеет наружную (внешнюю) мембрану. Наружная мембрана охватывает протоплазматический цилиндр и фибриллы.
Аксиальные (осевые) фибриллы располагаются в периплазматическом пространстве, между клеточной стенкой и наружной мембраной. Эти нитчатые структуры тянутся вдоль клетки трепонемы, обвиваясь вокруг её тела в периплазматическом пространстве. Они берут начало от базальных тел, расположенных на обоих концах клетки, и заканчиваются, пройдя середину клеточного цилиндра. Они идут от обоих концов к центру микроорганизма и перекрывают друг друга в центре.
Каждая фибрилла одним концом прикреплена вблизи конца клетки, а другой ее конец свободен. На обоих концах клетки прикреплено одинаковое число фибрилл; в середине или по всей длине клетки фибриллы перекрывают друг друга. В совокупности аксиальные фибриллы называются аксостилем (фибриллярным пучком).
По своим свойствам аксиальные фибриллы напоминают жгутики бактерий. Отличие заключается в том, что аксиальные фибриллы трепонем — внутриклеточные структуры и поэтому называются эндофлагеллами, т.е. внутренними жгутиками.
Т.к. пептидогликановый слой не защищает наружную мембрану, то она легко разрушается при экспериментальных манипуляциях. Фибриллы тоже при этом повреждаются и отстают от тела бактерии, что хорошо видно на многих снимках, полученных в результате электронной микроскопии.
Кроме того, внутри протоплазматического цилиндра также содержатся другие нитевидные структуры, функция которых до сих пор не ясна — цитоплазматические фибриллы, направленные параллельно периплазматическим эндофлагеллам (аксиальным фибриллам).
На концах трепонем наблюдаются структуры конической формы, расположенные в периплазматическом пространстве. По всей видимости, эти уникальные структуры состоят из липопротеинов, упорядоченных в виде спиральной решетки, примыкающей к наружной мембране.
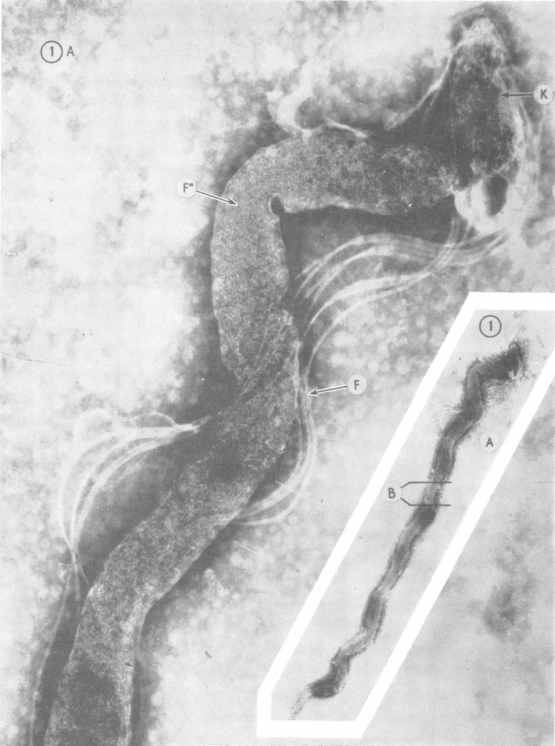 Трепонема, штамм Казань. Электронная микроскопия. K - головная структура. F - фибриллы. F" - цитоплазматические нити.
Трепонема, штамм Казань. Электронная микроскопия. K - головная структура. F - фибриллы. F" - цитоплазматические нити. 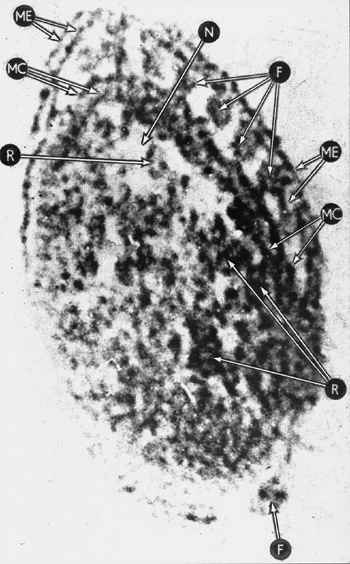 Срез бледной трепонемы (электронная микроскопия). (ME) - наружная мембрана. (MC) - цитоплазматическая мембрана. (F) - фибриллы. (R) - рибосомы. (N) - вакуоли.
Срез бледной трепонемы (электронная микроскопия). (ME) - наружная мембрана. (MC) - цитоплазматическая мембрана. (F) - фибриллы. (R) - рибосомы. (N) - вакуоли.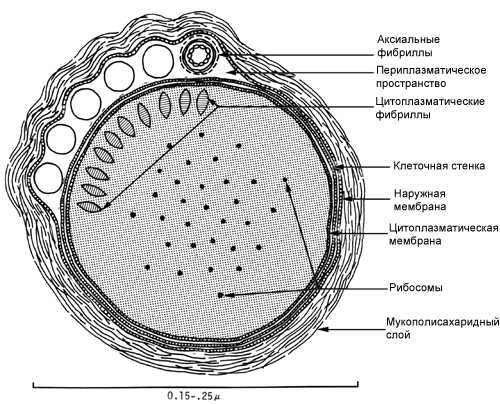 Схема среза бледной трепонемы
Схема среза бледной трепонемы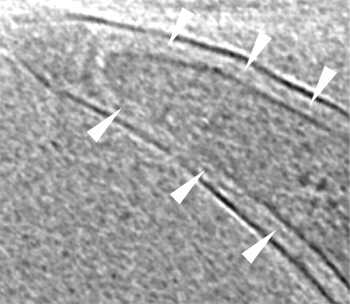 Срез концевого сегмента бледной трепонемы на крио-электронной томограмме. Белые треугольники указывают на пептидогликановый слой клеточной стенки, который хорошо видно рядом с концом клетки.
Срез концевого сегмента бледной трепонемы на крио-электронной томограмме. Белые треугольники указывают на пептидогликановый слой клеточной стенки, который хорошо видно рядом с концом клетки.Большинство (50—80%) свежеизолированных штаммов T. pallidum окружены слоем кислых мукополисахаридов, напоминающим капсулу. Однако не все уверены, что это собственный продукт трепонем, а не производное соединительной ткани хозяина. Если это так, то правильнее говорить о псевдокапсуле.
Геном бледной трепонемы
Так как бледная трепонема весьма важна с медицинской точки зрения, и не поддается культивированию на искусственных средах, то она стала одним из первых микроорганизмов, чей геном расшифровали исследователи. Для секвенирования был выбран штамм Nichols, выделенный в США еще в 1912 году. Геном микроорганизма представлен кольцевой двуцепочечной молекулой ДНК размером 1 138 006 пар оснований. ДНК содержит 1041 предсказанную кодирующую последовательность. Впоследствии были полностью секвенированы еще несколько штаммов T. pallidum. Ученые выяснили, что геномы штаммов отличаются, хотя и не очень значительно.
У микроорганизма идентифицировано 42 семейства генов, ответственных за основные жизнеобеспечивающие функции: механизмы репликации ДНК, транскрипции, трансляции, энергетический метаболизм, процессы клеточного деления и секреции белков.
Наличие небольшого генома с лимитированием процессов биосинтеза объясняет некоторые свойства этой бактерии. Помимо своего небольшого размера, геном бледной трепонемы имеет еще и другие своеобразные черты в виде повторяющихся генов или генов с внутренними повторами.
После расшифровки генома трепонем было выяснено, что 55% генома бледной трепонемы — это гены с предсказанной биологической ролью, 28% - ранее неизвестные гены и 17% генов не уникальны для T. pallidum, т.е. соответствуют белкам других видов бактерий.
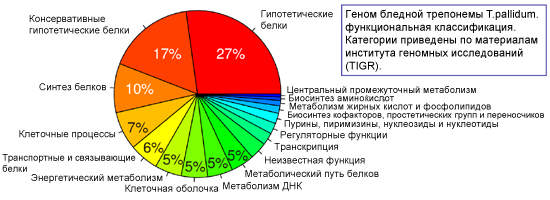
Важную роль в жизнедеятельности возбудителя сифилиса играет транспорт необходимых питательных веществ из окружающей среды. Этим объясняется присутствие широкого спектра транспортных белков с большим выбором субстратных специфичностей, кодируемых 5,7 % генома. Транспортные белки — это переносчики, связывающиеся с соответствующими субстратами внешней среды и транспортирующие их от наружной мембраны к цитоплазматической.
Как высокоспециализированный патоген, Т. pallidum не имеет в своем геноме генов, отвечающих за синтез ферментов, расщепляющих жирные кислоты, она использует сахара, содержащиеся в жидких средах организма хозяина. В качестве источников энергии микроорганизм использует глюкозу, галактозу, мальтозу и глицерин. Пути использования аминокислот как источника углерода и энергии в настоящее время не известны. Предполагают, что Т. pallidum не способна использовать аминокислоты как альтернативный источник энергии.
Одной из важнейших функций Treponema pallidum является движение, что обусловливает ее высокую инвазивность и возможность распространяться по жидкостям организма: внутрисуставной, глазной, экстрацеллюлярном матриксе и в коже. Двигательная активность обеспечивается 36 генами, кодирующими белки жгутиковых структур.
Антигенный состав бледной трепонемы
Бледная трепонема имеет сложный антигенный состав: в структуре клетки этой бактерии выявлено содержание большого количества соединений, обладающих выраженными антигенными свойствами. При этом антигены, входящие в состав клетки возбудителя сифилиса качественно неравноценны с точки зрения иммунного ответа (так называемая антигенная мозаичность).
Тело трепонемы (бактериальная клетка) содержит липидные компоненты, протеиновые (белковые) и полисахаридные комплексы, основная их часть локализуется в клеточной стенке. В сухом весе в составе бледных трепонем примерно 70% белков, 20% липидов и 5% углеводов. Это довольно высокое содержание липидов среди бактерий. Разными исследователями из клеток были выделены липополисахариды (ЛПС) и белковые фракции.
Практическое применение получили белковые и липидные антигены, поскольку серологическая диагностика сифилиса исторически основана на выявлении антител именно к этим антигенам. Белковые и липидные антигены используют при конструировании диагностикумов для поиска сывороточных антител. Некоторые липопротеины являются сильными иммуногенами, и антитела к ним можно обнаружить уже в конце инкубационного периода.
1. Липидные антигены бледной трепонемы
Липидный состав T.pallidum сложен: в составе бактерии обнаружены различные фосфолипиды, в том числе кардиолипин и недостаточно изученные гликолипиды. Фосфолипиды входят в состав цитоплазматической мембраны трепонемы. Эта мембрана экранирована внешними структурами бактериальной клетки.
Основной фосфолипидный антиген — кардиолипин. Неспецифический липидный антиген по своему составу аналогичен кардиолипину, фосфолипиду экстрагированному из бычьего сердца и представляющему по химической структуре дифосфатидилглицерол. Кардиолипин широко распространен в живой природе, и в конце концов его удалось обнаружить у трепонем. В отличие от кардиолипина, фосфолипиды и гликолипиды, обнаруженные в наружной мембране трепонемы, не реагируют с иммуноглобулинами в сыворотке больного сифилисом.
2. Белковые антигены бледной трепонемы.
Наибольший интерес для поиска новых антигенов T. pallidum представляют белки цитоплазматической и наружной мембраны, так как именно они в первую очередь являются мишенями для иммунной системы организма хозяина. На экспериментальных животных моделях было показано, что антитела к белкам наружной мембраны играют важную роль в элиминации возбудителя из макроорганизма. В то же время известно, что наибольшей иммуногенностью обладают липопротеины, локализующиеся на цитоплазматической мембране со стороны периплазмы, ввиду содержания в их структуре высокоиммуногенных радикалов жирных кислот.
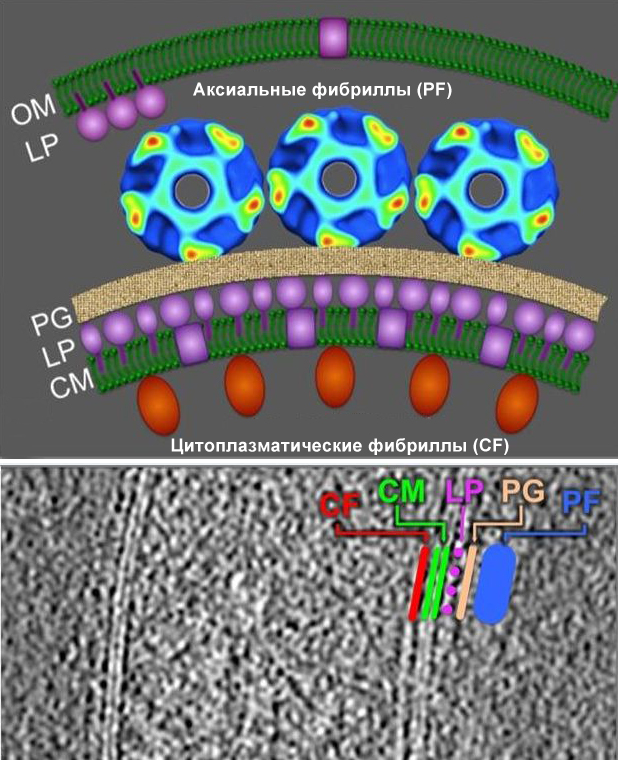 Клеточная архитектура T. pallidum в виде поперечного среза. (OM) - наружная мембрана с редкими белками (фиолетовый), (LP) - липопротеины, (PG) - тонкий слой пептидогликана, (CM) - цитоплазматическая мембрана, (CF) - цитоплазматические фибриллы Второе изображение — эти же структуры показаны на продольном срезе трепонемы, (PF) - аксиальные фибриллы
Клеточная архитектура T. pallidum в виде поперечного среза. (OM) - наружная мембрана с редкими белками (фиолетовый), (LP) - липопротеины, (PG) - тонкий слой пептидогликана, (CM) - цитоплазматическая мембрана, (CF) - цитоплазматические фибриллы Второе изображение — эти же структуры показаны на продольном срезе трепонемы, (PF) - аксиальные фибриллы3. Белки наружной мембраны.
Наружная мембрана клетки возбудителя сифилиса состоит из двух слоев липидных молекул (липидный бислой), в которые встроены белки.
Наружная мембрана трепонем напоминает внешнюю мембрану грамотрицательных бактерий, но, в отличие от них, не содержит потенциально вызывающего воспаление гликолипида липополисахарида (липополисахаридного эндотоксина).
В составе наружной мембраны трепонемы преобладают липиды. Количество белков, экспонированное на поверхности трепонем весьма мало, примерно в 100 раз меньше, чем у других грам-отрицательных бактерий. Поверхностные антигены T. pallidum представляют собой трансмембранные липопротеины. «Трансмембранные» — это означает, что белки пронизывают двойной слой липидов мембраны. Эти трансмембранные белки получили особое название — "редкие белки наружной мембраны бледной трепонемы" (T. pallidum rare outer membrane proteins, TROMP).
Эти белки слабоиммуногенны. Наружная мембрана бледной трепонемы почти лишена белков, которые могут служить мишенями для иммунной системы хозяина.
Данные о строении наружной мембраны существенно повлияли на представления о патогенезе сифилиса и физиологии трепонем.
Высказывается предположение, что малочисленность поверхностно-экспонированных белков, а не внешний чехол, ограничивает антигенность вирулентного микроорганизма и позволяют ему уклоняться от интенсивного гуморального иммунного ответа, развивающегося при вторичном сифилисе и более поздних стадиях болезни.
4. Высокоиммуногенные белки бледной трепонемы.
Основными антигенными детерминантами бледной трепонемы являются липопротеины, локализованные в периплазматическом пространстве и покрывающие наружный слой цитоплазматической мембраны.
Ряд исследований показал, что основными мембранными антигенами трепонем являются гидрофильные полипептиды, привязанные ковалентносвязанными N-концевыми липидами к периплазматической стороне цитоплазматической мембраны.
5. Белки цитоплазматической мембраны
Электронно-микроскопическое исследование замороженных срезов возбудителя показало, что белки цитоплазматической мембраны располагаются внутримембранно между двойным слоем липидов.
6. Модель молекулярной архитектуры бледной трепонемы
На основании комплекса молекулярных, биохимических и ультраструктурных исследований создана предположительная модель молекулярной архитектуры бледной трепонемы.
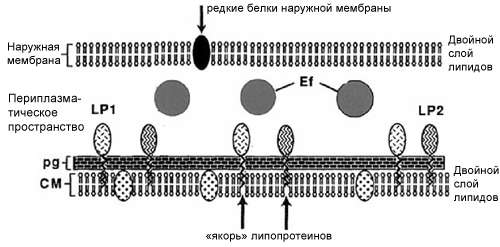 Молекулярная структура патогенной бледной трепонемы. Наружная мембрана содержит малое количество интегральных мембранных белков, т.наз «редких трансмембранных белков».
Молекулярная структура патогенной бледной трепонемы. Наружная мембрана содержит малое количество интегральных мембранных белков, т.наз «редких трансмембранных белков».
(CM) - цитоплазматическая мембрана и (pg) - пептидогликановый слой образуют комплекс. (LP1), (LP2) - мембранные иммуногены закрепляются посредством липидного якоря с внешней стороны цитоплазматической мембраны. (Ef) - фибриллы (эндофлагеллы), расположенные в периплазматическом пространстве.
Эта необычная молекулярная архитектура может объяснить впечатляющую способность бактерии ускользать от механизмов иммунологического надзора и наименование этого микроорганизма как стелс-патогена. Несмотря на значительные усилия исследователей, молекулярные механизмы, лежащие в основе патогенности бледной трепонемы в настоящее время недостаточно изучены.
7. Антегенная общность с непатогенными трепонемами
Основными антигенными детерминантами бледной трепонемы являются протеины, имеющие в своем составе фракции, общие для патогенных и сапрофитных трепонем, против которых синтезируются групповые антитела.Поэтому цельноклеточный антиген, полученный из разрушенной ультразвуком T. pallidum, редко используется для серологической диагностики сифилиса. В современных тест-системах в качестве антигена нашли применение рекомбинантные или синтетические пептиды. Первые получили большое распространение.
8. Подробное описание белковых антигенов бледной трепонемы
Описано около 30 разнообразных антигенов, сконцентрированных
главным образом в клеточной стенке и цитоплазматической мембране бледной трепонемы. На сегодняшний день описаны различные белки, имеющих молекулярную массу от 12 (сейчас известен как ТрN 15) до 97кДа. С помощью метода иммуноблоттинга были обнаружены и изучены полипептиды бледной трепонемы с молекулярной массой 15, 17, 24, 28, 29, 31, 33, 35, 37, 38, 39, 40, 41, 42, 43, 44,5, 45, 47, 53, 54, 57, 61, 62, 63, 65, 88, 97 кДа. Тр15-47 кДа (15, 17, 23, 37, 39, 45, 47) – встроенные в мембрану и флагеллярные белки, большинство из которых явяляются специфичными для T. pallidum.
В 1982 году S. A. Lukehart et al. исследовали большинство антигенов Т. pallidum путем электрофореза в полиакриламиде в технике Вестерн-блота и получили около 35 полипептидов с молекулярной массой от 14 до 100 кДа. Авторы обнаружили, что высоко иммуногенные липопротеины локализованы в периплазматическом слое цитоплазматической мембраны, а не содержатся в наружной мембране.
Наиболее иммунореактивными белками мембраны Т. pallidum являются 15, 17, 42 и 47 кД. Под иммунореактивностью в этой связи понимают способность реагировать со специфичными к возбудителю антителами.
По мнению ряда авторов, наиболее значимыми в диагностике сифилиса являются антитела к антигенам бледной трепонемы с молекулярной массой 15, 17, 44,5 и 47 кД.
Наименьшей молекулярной массой обладает белок цитоплазматической мембраны Тр 15. Во время сифилитической инфекции он вызывает образование IgМ. Тр 17 в основном представлен во внутренней мембране протоплазматического цилиндрического комплекса T. pallidum, в небольших количествах он обнаружен на наружной мембране. С определением антител к белкам Тр 47 и Тр 44,5 возлагают надежду для постановки серологического дифференциального диагноза сифилиса и болезни Лайма.
В структуре флагелл выделен белок Тр 37, а Тр 39 считается основным мембранным протеином. Ему принадлежит ведущая роль в запуске иммунного ответа.
Первым белком, используемым для ИФА, стал трансмембранный протеин TmpA (АГ с молекулярной массой 42 кДа). Он является периплазматическим металлосвязывающим протеином и вовлечен в транспорт металлов через цитоплазматическую мембрану. К его концевому фрагменту из 19 аминокислотных остатков АТ наиболее активны и встречаются в сыворотке большинства больных. Выявлена зависимость между титром АТ к TmpA и эффективностью терапии. По- этому он предлагался для использования с целью оценки качества лечения.
Поиск IgM к белкам Тр 37 и Тр 47 рассматривается в качестве варианта для постановки диагноза врожденного сифилиса у детей, рожденных от больных матерей. Протеин Тр 47 является цинк-зависимой карбоксипептидазой. Он принадлежит к иммунодоминантным белкам, продуцируется в больших количествах и для него не обнаружено перекрестных реакций с белками трепонем-комменсалов. В большинстве современных тест-систем для специфической диагностики сифилиса используют этот белок, чаще в комбинации с другими протеинами.
Образование АТ к Тр 83 обнаружено только при врожденном сифилисе, а среди фракций иммуноглобулинов найдено преобладание IgG1, IgG3.
Антиген T. pallidum с молекулярной массой 92кДа – это белок наружной мембраны, индуцирующий иммунный ответ. Он является мишенью для опсонизирующих антител. Гены, его кодирующие, консервативны в 95,5–100% случаев. Они очень похожи на гены, кодирующие белки мембран целого ряда бактерий, включая спирохету Borrelia burgdorferi и возбудителей инфекций, передающихся половым путем, Neisseria gonorrhoeae и Chlamidia trachomatis.
В экспериментах на морских свинках показано, что первыми в сыворотке появляются полипептиды с молекулярной массой 80–90 кДа и 47 кДа. Через 2 недели регистрировался спектр из 10 белков, молекулярная масса которых составила от 18 до 90 кДа. Через 2 месяца наблюдений среди 11 белков обнаружены новые с молекулярной массой 39 и 45 кДа на фоне элиминации белка 90 кДа.
Через 90 дней от момента появления первичного аффекта изучено 17 белков с молекулярной массой от 14 до 80 кДа. При определении титра АТ к Тр 18, 45-49, 70 показано, что он выше через 2 месяца от начала инфекции, чем через 5.
Ряд исследователей указывает на частую регистрацию ложноположительных результатов в трепонемных исследованиях для выявления сифилиса у пациентов с воспалительными заболеваниями периодонта за счет определения у них антител к антигенам TpN17 и TpN47. Указанное явление свидетельствует о недостаточной специфичности используемых для исследования антигенов ввиду их иммуногенной близости с антигенами микроорганизмов, вызывающих воспалительные изменения периодонта, в том числе и трепонем-комменсалов.
Исследования бледной трепонемы методами протеомики и функциональной геномики

Исследования особенностей бледной трепонемы в течение долгого времени были затруднены из-за невозможности длительного культивирования патогенных штаммов T. pallidum на искусственных средах. Это же служило препятствием для изучения иммунологических и физико-химических свойств большинства белков, входящих в структуру T. pallidum.
После расшифровки генома возбудителя сифилиса, осуществленного группой американских исследователей в 1998 году, произошел качественный скачок в области изучения бледной трепонемы, как и многих других микроорганизмов, геномы которых были расшифрованы в начале 90-х годов. Если раньше изучением структуры, функций и механизмов работы отдельных наборов генов занималась классическая генетика, то возникшая как область знаний геномика стала изучать огромные объемы данных о последовательностях нуклеотидов, полученные в результате исследований ДНК.
Хотя наличие данных по геному — это настоящая сокровищница информации для исследователей, однако геномные последовательности дают только "взгляд с высоты птичьего полёта" на биологические процессы, свойственные микроорганизмам. Рекордное обилие сведений по ДНК, которое нарабатывается методами современной геномики становится основанием для глобальной экспериментальной платформы — протеомики. Современные глобальные методы протеомики сочетают компьютерные и биологические подходы.
Протеомика — современное направление молекулярной биологии, занимающееся сравнительным изучением белков, которые могут быть экспрессированы микроорганизмом в определенную фазу жизнедеятельности, предсказанием функциональной роли отдельных белков путем экспериментального сопоставления их качественного и количественного составов в разных клетках, а также установлением взаимосвязи структуры белка и его функций.
Благодаря развитию методов протеомики стало возможным широкомасштабное изучение белкового состава различных организмов, в том числе и возбудителя сифилиса.
Состав белков T. pallidum в настоящее время изучается методами протеомики и функциональной геномики, что значительно расширило знания об антигенной структуре микроорганизма. С использованием протеомных методов исследования было выявлено и охарактеризовано более сотни новых иммуногенных белков T. pallidum. В частности, появилась серия работ по изучению протеома возбудителя сифилиса с целью выявления новых белков, представляющих интерес для создания вакцины или диагностикумов на их основе.
Недостаток этого подхода в том, что вычислительные программы могут предсказать белковый состав трепонем, но не позволяют определить расположение белка в клетке.
Основополагающими исследованиями в этой области стали работы М. Brinkman и соавт. (2006), которые провели серологический скрининге библиотеки рекомбинантных белков T. pallidum. Серологический скрининг нативных белков, разделенных методом двумерного электрофореза, был представлен в работе М. McGill и соавт. (2010).
запись по телефону 8 (985) 970-30-92 ежедневно с 7.00 до 23.00
ПРИЕМ ТОЛЬКО ПО ЗАПИСИ! ЗВОНИТЕ.
Медицинский центр "На Ленинском" - ежедневно. ЗАПИСЬ!
Медицинский центр "На Самотечной" - cуббота, воскресенье.
По предварительной записи!



