Прямые методы лабораторной диагностики сифилиса
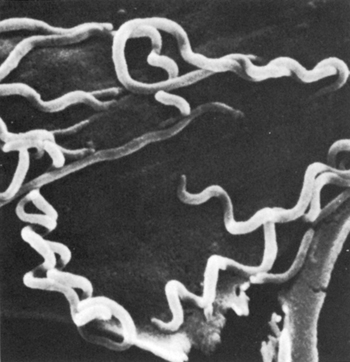
Прямые методы диагностики служат для выявления бледной трепонемы (Т. pallidum) или генетического материала этого возбудителя в образцах, взятых из очагов поражения. Прямое выявление возбудителя сифилиса является абсолютным доказательством наличия заболевания. Найденный генетический материал (ДНК/РНК) может свидетельствовать как об активном, так и о ранее леченном сифилисе.
На ранней стадии болезни, возбудитель сифилиса активно размножается в очаге инфицирования, при этом антитела к антигенам бледной трепонемы (Treponema pallidum) начинают появляться только со второй недели после инфицирования. Бледная трепонема располагается в тканевых щелях, между волокнами соединительной ткани, вокруг лимфатических и кровеносных сосудов, в стенках и даже просветах лимфатических капилляров.
При медицинском обследовании, у пациентов с подозрением на сифилис, все высыпания на коже или слизистых оболочках следует считать сифилитическими. Исследованию на бледную трепонему подлежат все эрозивные и язвенные шанкры, мокнущие и эрозивные папулы, широкие кондиломы на коже и слизистых оболочках рта, половых органов и анальной области.
Материалом, который необходим для бактериологического исследования на бледную трепонему, является тканевая жидкость (серум). Если нет возможности исследовать высыпания (например, в случаях раннего сифилиса), то рекомендуется проводить пункцию увеличенного регионарного лимфатического узла с соблюдением всех правил асептики, то есть стерильными инструментами и соблюдая правила, направленные на предотвращение распространения микроорганизмов. Кроме того, образцы могут быть получены путем взятия спинномозговой жидкости (ликвора) или плодной жидкости.
Важным условием для обнаружения бледной трепонемы в пат. материалах является правильное взятие проб из сифилитических элементов. Затем содержимое полученных проб изучают в лаборатории.
Обнаружение бледной трепонемы методом темнопольной микроскопии (ТПМ).
В России в качестве рутинного метода прямой визуализации T. pallidum традиционно используется метод темнопольной микроскопии (ТПМ, dark field microscopy, DFM).
1. Конденсор темного поля
Исследование на бледную трепонему в темном поле зрения проводится с помощью стандартного микроскопа, снабженного конденсором темного поля.
Конденсор представляет собой двояковыпуклую линзу, прикрепляемую снизу предметного столика с таким расчетом, чтобы линза конденсора располагалась под отверстием предметного столика. Конденсор служит для собирания (конденсации) пучка световых лучей, что обеспечивает наибольшее освещение исследуемого предмета.
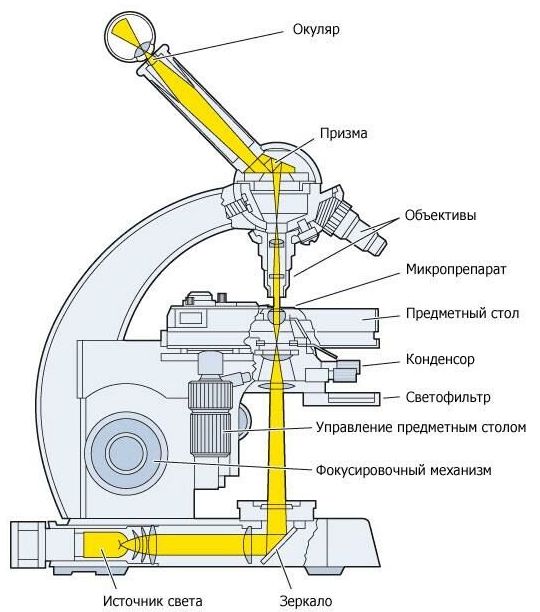
Неокрашенные живые бледные трепонемы не видны в световой микроскоп при обычном освещении препарата. Необходимые условия создаются путем замены обычного конденсора микроскопа особым конденсором, в котором центральная часть затемнена и проникновение лучей света происходит через узкую щель.
Вследствие получающегося при этом бокового освещения достигается отраженное свечение всех твердых частиц на темном поле (это называется "эффектом Тиндаля"), в том числе бледной трепонемы. Для получения темного поля необходим сильный источник света.
2. Бледная трепонема, характерные особенности при темнопольной микроскопии
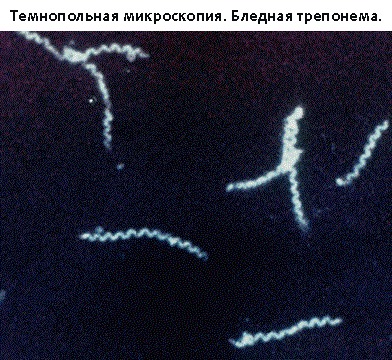
Исследование в темном поле микроскопа позволяет изучать бледную трепонему (БТ) в живом виде, а также достоверно отличать её от других трепонем как по морфологическим признакам, так и по характерным особенностям движения.
Чтобы отличать бледную трепонему от морфологически сходных типов сапрофитных трепонем, бледные трепонемы при исследовании должны быть живыми. Темнопольное исследование взятого материала должно быть проведено немедленно, сразу после получения образца, поэтому оборудование должно быть подготовлено заранее.
В затемненном поле зрения бледная трепонема выглядит, как движущаяся тонкая спираль или тонкий нежный пунктир с серебристым оттенком, слабо преломляющие свет. Помимо этих бактерий, в препарате все поле зрения усеяно массой мельчайших светящихся точек, находящихся в хаотичном броуновском движении.
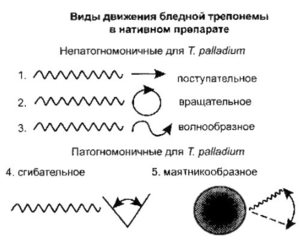
Бледные трепонемы движутся характерным образом: вращаются вокруг своей продольной оси, перемещаются в одном направлении, качаются наподобие маятника или совершают волнообразные, сократительные или сгибательные движения ("шагающая трепонема"). Бледная трепонема движется плавно, что является важной особенностью этого микроогранизма.
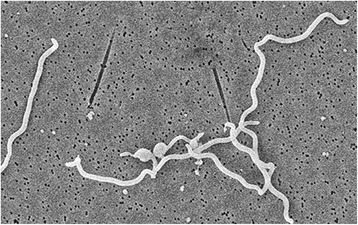 T. phagedenis, электронная микроскопия
T. phagedenis, электронная микроскопияВ полости рта и на половых органах встречаются сапрофитные трепонемы: T . refringens и T. phagedenis (reiteri) в урогенитальном тракте и T. denticola в полости рта.
Непатогенные трепонемы морфологически сходны с T. pallidum. От них бледную трепонему отличает толщина, характер движения и форма завитков.
T.refringens колонизирует наружные половые органы. Эта бактерия движется быстро и неравномерно, отличается большей толщиной, отсутствием сгибательных движений, и более пологими и широкими завитками. T.denticola является представителем нормальной микрофлоры полости рта, ее завитки короче и направлены под более острым углом. В нормальной флоре наружных половых органов человека встречается также T. phagedenis.
Наличие непатогенных трепонем затрудняет исследования материала, взятого из поражений в полости рта или прямой кишке. При дифференциации трепонем может ошибиться даже опытный исследователь, поэтому присутствие этих микроорганизмов делает малодостоверным проведение исследования с данным материалом. Если необходимо провести тестирование материала, полученного из одного из указанных выше мест, то предпочтительнее выполнить DFA или NAAT (лучше отдать предпочтение методу ПИФ или молекулярно-биологическим методам).
Методом темнопольной микроскопии невозможно отличить бледную трепонему от патогенных возбудителей других трепонематозов — T. pallidum carateum (пинта), T. pallidum pertenue (фрамбезия), T. pallidum endemicum (беджель).
3. Применение темнопольной микроскопии для диагностики сифилиса
Микроскопию в темном поле можно применять для диагностики первичных и вторичных поражений кожи при сифилисе в результате заражения половым путем. В редких случаях этот метод можно использовать при третичном сифилисе (в последнем случае — если материал взят из глубины инфильтрата или со дна язвы).
Также с помощью этого метода исследуют поражения при раннем врожденном сифилисе, когда заражение плода бледной трепонемой произошло в утробе матери. Чтобы подтвердить диагноз "врожденный сифилис", для приготовления препарата для микроскопии можно использовать ткань пуповины, органы плода, выжатый сок плаценты, амниотическую (плодную) жидкость, отделяемое слизистой оболочки носа, содержимое пузырей (при ладонно-подошвенной сифилитической пузырчатке), тканевой жидкости (серума) с раздраженных папул.
Метод темнопольной микроскопии, используемый для диагностики сифилиса, отличается простотой, дешевизной, быстротой и достаточно высокой чувствительностью. Однако у него есть известные недостатки – невозможность диагностики скрытых и поздних форм сифилиса и непригодность для контроля излеченности. Даже многократный отрицательный результат микроскопического исследования на бледную трепонему не может исключить сифилис.
Кроме того, для проведения исследования методом ТПМ микроорганизмы T. pallidum должны быть подвижными. В условиях применения пациентами различных антибактериальных препаратов, в том числе для лечения других заболеваний, диагностическая чувствительность ТПМ снижается. В подобных случаях необходимо исследование методом прямой иммунофлюоресценции (ПИФ) или проведение серологического обследования на сифилис.
Для повышения информативности лабораторной диагностики разрабатываются более чувствительные и специфичные прямые тесты на основе молекулярно-биологических технологий, например различные модификации метода ПЦР.
Метод прямой иммунофлюоресценции (ПИФ)
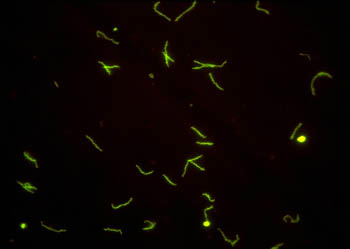
При необходимости микроскопия возбудителя в темном поле может быть дополнена прямой реакцией иммунофлюоресценции (ПИФ, direct fluorescent antibody test, DFA).
Прямой метод иммунофлюоресценции (по Кунсу) основан на взаимодействии антител, меченых флюорохромом, с антигеном, который находится на клетке, в клетке или в тканях. В качестве флюорохрома используют флюоресцеинизотиоционат (ФИТЦ).
Метод прямой иммунофлюоресценции предусматривает прямое выявление T. pallidum в образце при обработке материала специфическими моноклональными антителами. При этом на запарафинированные мазки или биопсийный материал накладываются противотрепонемные антитела, меченные флюоресцирующим красителем. Затем, образующиеся комплексы антиген—антитело исследуют под люминесцентным микроскопом.
В результате взаимодействия анти- T.pallidum антител, меченных ФИТЦ, и бледной трепонемы при люминесцентной микроскопии наблюдается специфическое ярко-зеленое свечение: бледная трепонема флюоресцирует ярко-зеленым цветом, сохраняя все морфологические признаки спирохеты.
Забор образцов производится таким же образом, как и для темнопольной микроскопии, при этом сам метод ПИФ является более точным, чувствительным и специфичным, чем ТПМ.
Метод ПИФ имеет преимущества перед темнопольной микроскопией для выявления бледной трепонемы. Флюоресцирующие микроорганизмы проще детектировать, вероятность спутать их с другими видами трепонем снижена. При этом возможна дифференцировка патогенных трепонем от непатогенных при исследовании материала со слизистых полости рта и прямой кишки, фиксация препаратов перед транспортировкой в лабораторию. Для исследования может быть использован материал, полученный при биопсии или аутопсии.
Зарубежные эксперты в настоящее время относят этот метод к числу устаревших из-за трудоемкости по сравнению с ТПМ и по причине того, что исследование не может быть выполнено «у постели больного» из-за необходимости использовать специализированное оборудование.
Кроме того, применение ПИФ ограничено из-за отсутствия промышленного производства и сертификации соответствующих ингредиентов в ряде стран, в частности, ФИТЦ-меченых моноклональных антител к патогенной бледной трепонеме.
Метод полимеразной цепной реакции (ПЦР)
Для диагностики сифилиса применяется прямой метод определения ДНК бледной трепонемы — метод ПЦР; это один из методов амплификации нуклеиновых кислот (МАНК, nucleic acid amplification test, NAAT).
Метод полимеразной цепной реакции (ПЦР) позволяет исследовать различные образцы (отделяемое сифилидов, биопсийный материал, биологические жидкости) в свежем, замороженном, фиксированном и парафинированном виде. В качестве объекта исследования методом ПЦР могут быть использованы соскобы шанкров и других высыпаний (папул, широких кондилом и т.д.), спинномозговая, амниотическая жидкость, сыворотка крови.
Метод ПЦР, предложенный в 1983 году сотрудником фирмы «Cetus» (США) Kary Mullis, заключается в амплификации (размножении) в пробирке определенных участков ДНК возбудителя в процессе повторяющихся температурных циклов. Преимуществом методики является то, что при ПЦР-диагностике размножению подвергается не сама бактерия, а только ее ДНК, причем не вся молекула ДНК, а только определенный фрагмент, являющийся маркером данного возбудителя.
ПЦР–тесты для выявления ДНК бледной трепонемы были разработаны в 1991 году одновременно в нескольких лабораториях. Этот метод позволяет выявить и идентифицировать единственную молекулу ДНК бледной трепонемы среди сотен тысяч других молекул, что делает потенциально возможной диагностику нейросифилиса, третичного, врожденного сифилиса при наличии единичных трепонем в исследуемом материале.
Метод ПЦР высокоспецифичен, чувствителен и воспроизводим при правильном проведении и подготовке образцов. Однако, применительно к диагностике сифилиса, методы МАНК пока используется в исследовательских целях.
Разработаны различные модификации метода ПЦР, которые используются для диагностики сифилиса:
- PCR в режиме реального времени (PCR-RT). Учет полученных результатов происходит автоматически в режиме реального времени по уровню свечения флюорохромных меток;
- методика PCR-анализа с помощью обратной транскриптазы (PCR-ОТ);
- мультиплексная PCR (PCR-М, М-ПЦР), которая позволяет в биологической пробе одновременно определять наличие возбудителей нескольких заболеваний.
Основными достоинствами метода ПЦР и его модификаций является универсальность (возможность обнаружить любые нуклеиновые кислоты), весьма высокая чувствительность (80 – 94,7 %) и высокая специфичность (до 100 %). Результат получается быстро, для анализа необходима проба малого объема (несколько микролитров). Современные методы ПЦР позволяют одновременно исследовать нескольких возбудителей заболеваний, а также получать документальный ответ в виде фотографий и вносить результаты диагностики на компьютерные информационные носители. К недостаткам метода ПЦР-анализа следует отнести высочайшие требования к оснащению лаборатории, качеству тест–наборов и регламенту исследования.
Метод ПЦР является дополнительным и может быть рекомендован, главным образом, для исследования отделяемого эрозивных и язвенных высыпаний при подозрении на первичный сифилис, особенно при их локализации на слизистой оболочке рта; при применении пациентами местных и системных антибактериальных средств накануне обращения к врачу; при отрицательных результатах серологических тестов в начале первичного периода, когда ошибка метода ТПМ особенно значима.
Развитие высокочувствительного метода ПЦР и разработка его модификаций, оценивается как весьма перспективное. Особую важность этот метод приобретает при диагностике первичного серонегативного сифилиса (при котором серологические исследования дают отрицательный результат), раннего скрытого, врожденного сифилиса и нейросифилиса.
Препятствием к широкому внедрению метода ПЦР для диагностики сифилиса является отсутствие в массовой доступности тест-систем, разрешенных к медицинскому применению. В США применение ПЦР рекомендовано лабораториям, располагающим соответствующими тест-системами (в том числе созданными в самих лабораториях, in house). В России и странах Восточной Европы широкое использование метода лимитируется небольшим количеством наборов реагентов, прошедших валидацию и разрешенных к медицинскому применению на территории соответствующих государст
NASBA
NASBA - Nucleic Acid Sequence-Based Amplification, амплификация, основанная на последовательности нуклеиновых кислот (другие переводы - реакция амплификации на основе нуклеотидной последовательности нуклеиновых кислот, реакция транскрипционной амплификации). Методика NASBA основана на выделении РНК микроорганизма (в отличие от полимеразной цепной реакции, где используется ДНК). Этот метод тестирования считается одним из самых перспективных и многообещающих направлений молекулярной диагностики.
Использование в качестве мишени для NASBA видоспецифических участков рибосомальной РНК обеспечивает методу высокую специфичность. Так как РНК — менее стабильный по сравнению с ДНК тип генетического материала, который быстрее деградирует при разрушении клеток, то на основании результатов выявления РНК можно судить о наличии в образце жизнеспособных микроорганизмов, например, после проведенного лечения. С практической точки зрения важно, что для проведения NASBA в лабораторных условиях используется то же оборудование, что и для проведения ПЦР в реальном времени (PCR-RT). Кроме того, исходный биоматериал после ПЦР может исследоваться методом NASBA. В результате этого существует возможность интегрирования указанного метода в протокол лабораторного обследования, что позволит верифицировать возбудителя
Отдельные исследовательские коллективы уже получают достаточно перспективные результаты при изучении сифилитической инфекции методом NASBA и NASBA-RT, используя в качестве качестве мишени фрагмент гена 16s рРНК бледной трепонемы. Полученные данные позволяют отнести метод NASBA к диагностически перспективным в изучении сифилитической инфекции наряду с имеющимися методами диагностики.
Заражение сифилисом лабораторных животных
Задолго до открытия бледной трепонемы многие ученые стали проводить эксперименты по заражению сифилисом разнообразных животных. В естественных условиях животные сифилисом не болеют, но возможно искусственное заражение некоторых их видов. Первые успешные опыты были проведены на шимпанзе в начале 20-го века. Дальнейшие опыты на обезьянах привели к ряду блестящих научных открытий, но ввиду трудностей содержания и дороговизны обезьян, основными лабораторными животными стали кролики. Опыты с другими животными (холоднокровными, птицами, различными млекопитающими) давали отрицательный или недостаточный для практического применения результат. Некоторое значение имели только данные, полученные на морских свинках и мышах.
Заражение сифилисом кроликов является старейшим методом прямого выявления бледной трепонемы, т.к. кролик является наиболее чувствительным и удобным лабораторным животным для привития сифилиса. Заражение кроликов производят инокуляцией (введением микроорганизмов в ткани, от латинского inoculatio - "прививка") инфекционного материала в яичко. Чувствительность кроликов к инфекции Treponema pallidum практически 100%, если во взятом для прививки материале содержится достаточное количество бледных трепонем.
В качестве метода прямой детекции бледной трепонемы заражение сифилисом лабораторных животных уже давно не применяется для клинической лабораторной диагностики сифилиса. Работа с кроликами требует больших затрат на содержание хорошо оборудованного вивария. Это дорого, трудоемко и результат достигается только через достаточно продолжительное время. В настоящее время данный метод используется только в крупных исследовательских центрах в качестве «золотого стандарта» для оценки чувствительности других тестов.
запись по телефону 8 (985) 970-30-92 ежедневно с 7.00 до 23.00
ПРИЕМ ТОЛЬКО ПО ЗАПИСИ! ЗВОНИТЕ.
Медицинский центр "На Ленинском" - ежедневно. ЗАПИСЬ!
Медицинский центр "На Самотечной" - cуббота, воскресенье.
По предварительной записи!



